深度报道 深度报道【联创讲堂】陕西省仿制药一致性评价现状及形势分析(上)来源:发布时间:2017-02-19 00:17 还记得上周小智 预告过的【联创讲堂】 聚焦陕西仿制药一致性评价吗 作为我们新增加的微信内容 一经预告,就受到医药行业广泛关注 大家对''仿制药一致性评价 最感兴趣主题''的投票 我和我的小伙伴们也看到了 感谢大家支持,小智在这里抱拳谢过
请放心,你们想知道的 就是我们【联创讲堂】要分享的 下面,就开始聚焦陕西仿制药一致性评价 第一个主题的分享吧
分享嘉宾
齐华锋
(西安泰科迈医药科技股份有限公司研发总监)
毕业于西北轻工业学院生物化工专业
在仿制药研发领域拥有近20年实践经验
现任西安泰科迈医药科技股份有限公司
研发总监
全面负责公司仿制药
及仿制药一致性评价研发工作
仿制药一致性评价是在2012年“十二五规划”提出的,到2015年8月正式推进。目前,我国批准上市的药品有1.6万个,药品批准文号18.7万个,化药0.7万种,批准文号12.1万个。
这些药物中的绝大多数是仿制药,但总体质量与原研药相差甚远,有的甚至被认为是安全无效药,其内在质量和疗效亟待提高。在这样的形势下,国家开展仿制药质量一致性评价,倒逼制药行业升级,为整体提升我国医药质量提供契机。
国家食药监总局发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2016年第106号),明确289个必须于2018年底前完成一致性评价的化学药品仿制药口服固体制剂品种及其相应的规格。
2007年10月1日后批准上市的仿制药品自第一家通过一致性评价后,三年后不再受理其他药品生产企业的同品种一致性评价申请,这意味着如果没有通过药品一致性评价则失去了药品集中采购的机会。
陕西省药品批准文号约6600个,化学药品批准文号约3800个,药品生产企业约227家。时限是凡2007年10月1日前批准上市的列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂(289个),原则上应在2018年底前完成一致性评价,其中需开展临床有效性试验和存在特殊情形的品种,应在2021年底前完成一致性评价;逾期未完成的,不予再注册。
化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种,原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。
通过后的优势:通过一致性评价的药品品种,在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用。同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。
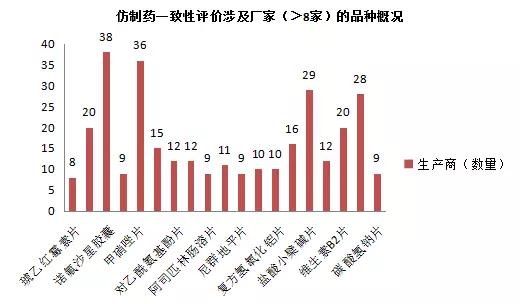
陕西省接近80%的药品生产企业持有基药目录中的品种,药品种类多达87种,作用类别广泛,如下图(点击图片可查看高清原图):
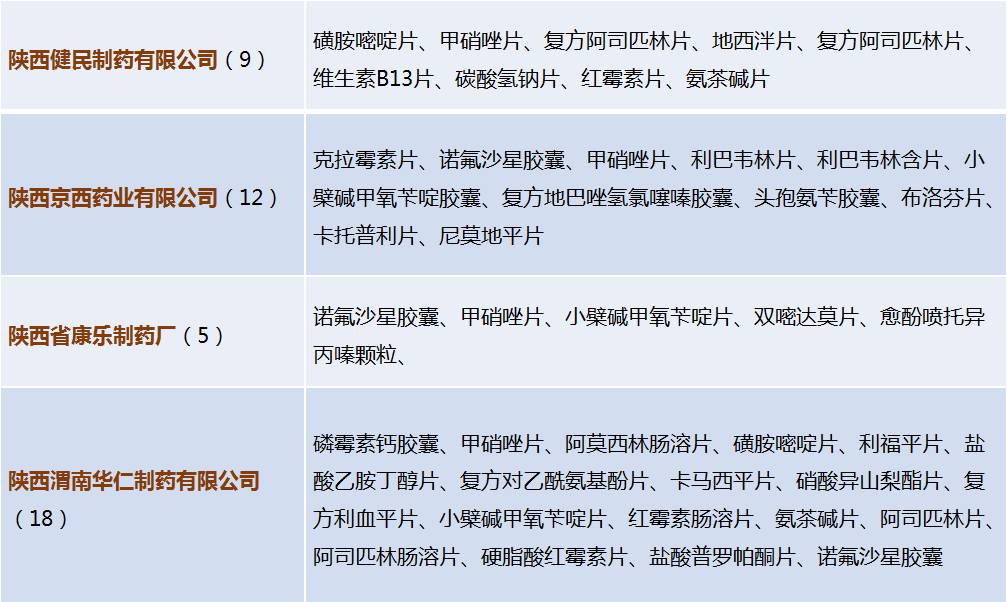
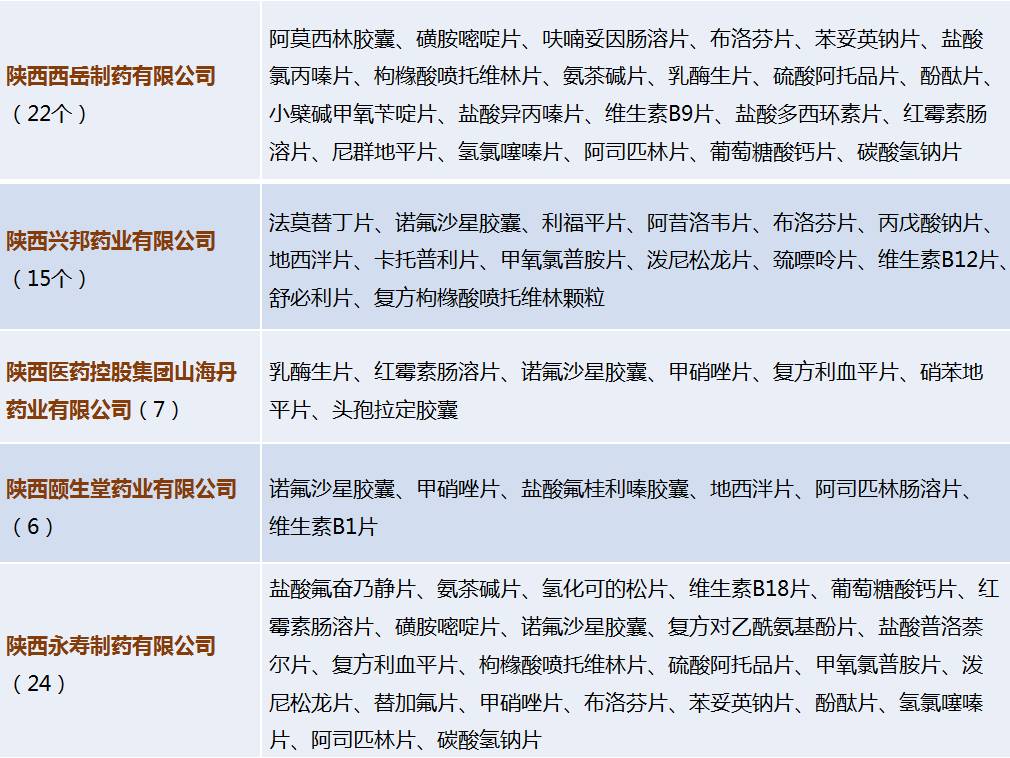
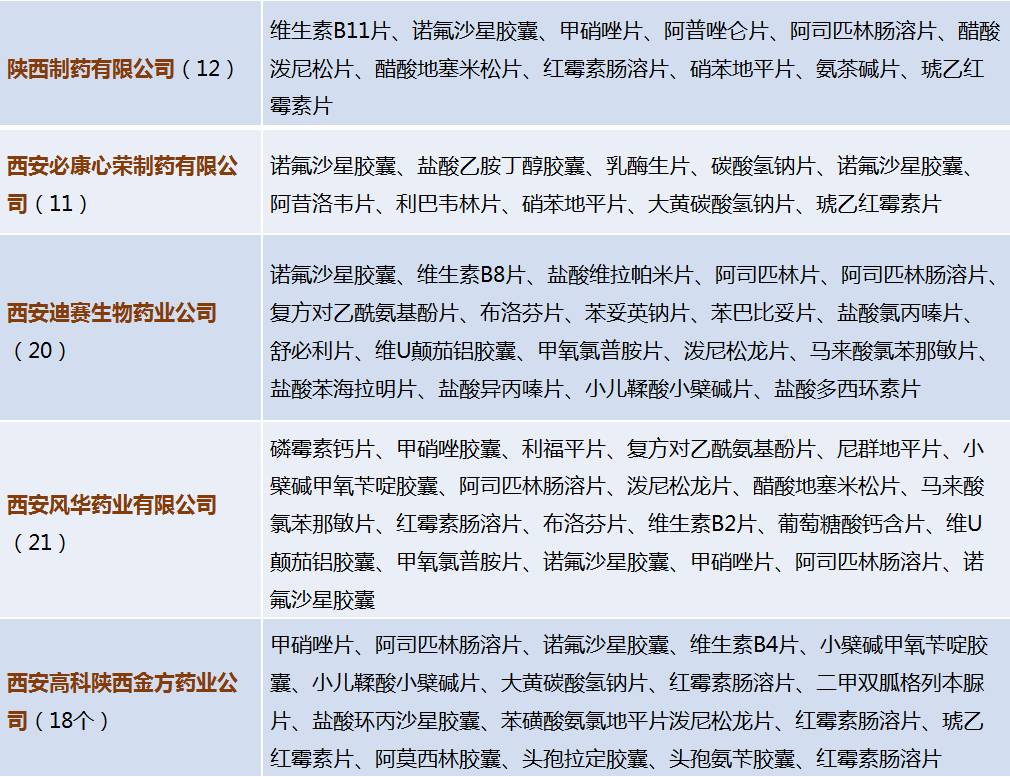
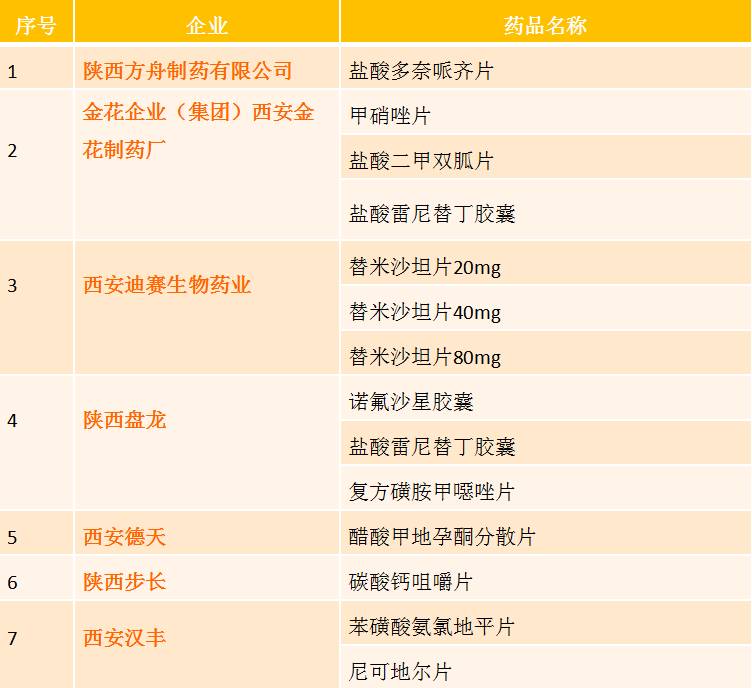
主要企业仿制药一致性评价信息
根据一致性评价办公室2016年5月20日至11月4日的企业备案信息,共有3502个药品备案。其中,陕西省仅有11家企业有参比药备案信息。备案详情如下:
看到这里 你是不是意犹未尽呢 下周,【联创讲堂】会继续发送 陕西仿制药一致性评价现状 及形势分析(下)的相关内容 敬请期待吧
|